SEMANA 01
clase 01
NOTAS QUE SE DIGITARÁN EN LA PLANILLA
CASILLA 1-2-3-4--CORRESPONDE AL ASPECTO COGNITIVO QUE SE VALORARÁ POR PARTICIPACION EN CLASE Y EVALUACIÓN.
CASILLA 5-6-7-8 CORRESPONDE AL ASPECTO PROCEDIMENTAL O SEA TALLERES Y CUADERNO.
CASILLA 5. NOTA SOBRE ENERGIA Y ENTALPIA ( CUADRO SINOPTICO DE TERMODINAMICA)
CASILLA 6 Nota sobre taller semna seis
casilla 7 Nota sobre taller semna siete
casilla 8 Nota sobre taller semna ocho
casilla 9 Nota sobre laboratorio
Casilla 10 Nota definitiva del periodo.
Malla curricular
clase 02 Energía
ENERGíA
Motivación a conocer la definición cientifica de la Enegia en procesos, físicos, químicos y biológicos.
ESTA LA PRESENTACION EN EL DRIVE
clase 03 eL ELECTRÓN
CLASE 04 NikolaTesla
clase 05 leyes de la termodinámica
SEMANA 02
clase 01
clase 02
clase-03-04-05
calor, temperatura.
Semana 03
EVALUACIÓN DE CIENCIAS NATURALES
MATERIA Y ENERGIA
CALOR Y TEMPERATURA
DIAGRAMA DE FLUJOS
TALLER PARA LA SEMANA 03---LA CASILLA NUMERO SEIS
-VER EL VIDEO DE QUE ES ENTROPIA Y COPIAR LOS CONCEPTOS EN EL CUADERNO
-VER EL VIDEO DE TRANSFERENCIA DE CALOR ( CONVECCIÓN, CONDUCCIÓN Y RADIACIÓN) PARA COPIAR LOS CONCEPTOS Y REALIZAR LOS DIBUJOS
-IMPRIMIR O DIBUJAR LAS SIGUIENTES GRAFICAS
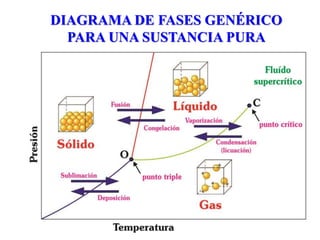

Modelo del diagrama de fases típico de una sustancia de único componente en función de la temperatura y la presión. La línea roja muestra la interfase sólido-gas. La línea verde muestra la forma habitual de la interfase sólido-líquido, mientras que la alineación de puntos verdes muestra el comportamiento anómalo de dicha interfase para el agua (hielo-agua líquida). La línea azul muestra la interfase líquido-gas.

Diagrama de fase del agua. Los ejes de presión y temperatura no están a escala.
- Punto triple: Punto en el que las tres fases coexisten en equilibrio. A una presión menor que el punto triple, el agua no puede existir en forma líquida, independientemente de la temperatura.
- Punto de fusión: Temperatura a la que se derrite el hielo.
- Punto de ebullición: Temperatura a la que se evapora el agua.
- Presión crítica: Presión requerida para licuar un gas a su temperatura crítica.
- Punto crítico: Temperatura y presión crítica de una sustancia. Más allá del punto crítico, las propiedades físicas del agua son intermedias, entre los estados gaseoso y líquido. Este estado se llama fluido supercrítico.
Podemos usar el diagrama de fase para identificar el estado físico de una sustancia bajo condiciones concretas de presión y temperatura. Por ejemplo, a 15 atm y -15 oC podemos observar que el agua existe en estado sólido.
El límite entre el sólido y el líquido sigue una curva negativa, lo que significa que el punto de fusión del hielo disminuye conforme aumenta la presión externa. En contraste, el límite entre líquido y gas sigue una curva positiva. Esto quiere decir que el punto de ebullición del agua aumenta conforme aumenta la presión externa.

El siguiente diagrama de fases del agua muestra que a la presión de 1 atm el agua pasa de sólido a líquido a 0 ºC y que pasa de líquido a gas a 100 ºC (línea roja). Sin embargo, si la presión fuera inferior (como ocurre en lo alto de una montaña) el agua fundiría a una temperatura algo mayor que 0 ºC y herviría a una temperatura inferior a 100 ºC. El intervalo de temperaturas en las que existiría el líquido se estrecharía.
En el caso de agua el punto triple se encuentra a 0,01 ºC y 0,00604 atm. Este punto representa la presión más baja a la que puede existir agua líquida. Por debajo de esa presión, el hielo está en equilibrio con el vapor y al subir la temperatura no funde sino que sublima. Otra característica de este diagrama es que la línea sólido-líquido está inclinada hacia la izquierda y no hacia la derecha, como es común. Eso es consecuencia de que, a medida que aumenta la presión, la temperatura de fusión del hielo disminuye. Por ejemplo, a 200 atm el hielo funde a -1,6 ºC. Esa es una de las consecuencias de tener un sólido menos denso que el líquido (como el antomonio o el bismuto).
¿Por qué no puede existir agua líquida en la Luna?
La presión en la superficie de la Luna es inferior a la del punto triple del agua, por tanto, en la Luna no puede existir agua líquida pero sí hielo. De hecho, en los cráteres de la Luna que se encuentran en oscuridad permanente (polos), se ha encontrado agua sólida. Dada la inexistencia de atmósfera y una presión casi nula en su superficie, el agua lunar debe pasar directamente a gas, debe sublimar. Posteriormente, las moléculas de agua serían rotas por la radiación que barre la superficie.
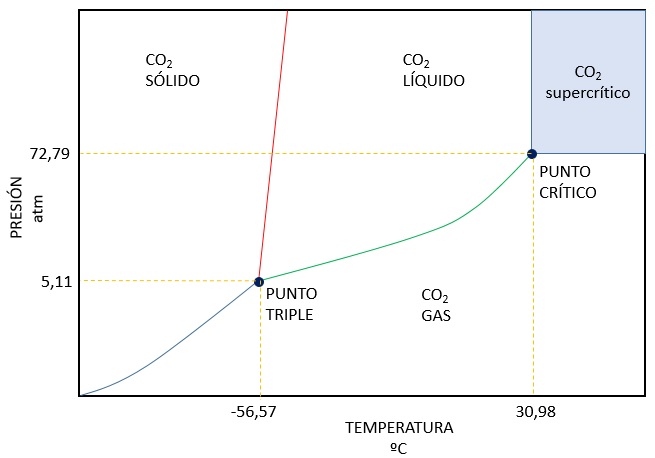
El dióxido de carbono no existe como líquido por debajo de 5,11 atm, por tanto, en condiciones normales de presión y temperatura sublima

Por otra parte, el punto crítico de esta sustancia es fácilmente accesible (72,79 atm y 30,98 ºC), lo que hace que el dióxido de carbono supercrítico se esté usando para muchas aplicaciones industriales (por ejemplo, quitar cafeína al café).
SEMANA 04 y 05
VERIFICACIÓN DE NOTAS EN LA PLANILLA
CLASE 01/S4

CLASE 02/S4

CLase03/S4
CLASE04/S4

CLASE 05/S4

CLASE 01/S5

CLASE 02/S5
CLASE 03/S5

CLASE 04/S5

hora del jueves
CLASE 05/S5

Semana seis
clase 01

clase 02
clase 03
SEMANA 07
preguntas tipo icfes
pregunta cinco de circuito
SEMANA 08
SEMANA 09
cuadernillos pruebas saber 11 para descargar
SEMANA 10
los hidrocarburos



SEMANA 11
O
ll
H - C-OH

